生物屋 2024-04-28 21:48 上海
·
血管生成(Angiogenesis)是正常组织生长及损伤修复的必要过程,是从已有的毛细血管或毛细血管后静脉发展而形成新的血管,其对于器官生长、胚胎发育和伤口愈合在内的多种过程十分重要
。
·
肿瘤组织具有高度血管化的特征,肿瘤的生长依赖于新生血管,新生血管也可能是肿瘤治疗的靶标,由于发现了血管生成因子对血管生成的作用,以及血管生成对肿瘤生长和侵入转移、特别对肿瘤早期发生的重要影响,肿管生成成为近年来肿瘤研究的热点之一,为肿瘤治疗开辟了一个新的思路。
·
肿瘤血管生成是一个极其复杂的过程,一般包括包括血管内皮基质降解、内皮细胞移行、内皮细胞增殖、内皮细胞管道化分支形成血管环和形成新的基底膜等步骤
。
无论原发性肿瘤还是继发性肿瘤,一旦生长直径超过 1-2 mm,都会有血管生成
。这是由于肿瘤细胞自身可分泌多种生长因子,诱导血管生成,多数恶性肿瘤的血管生成密集且生长迅速。
·
由于肿瘤组织新生血管结构及功能异常,且血管基质不完善,这种微血管容易发生渗漏,因此肿瘤细胞不需经过复杂的侵袭过程而直接穿透到血管内进入血流并在远隔部位形成转移。
·
越来越多的研究表明,良性肿瘤血管生成稀少,血管生长缓慢;而大多数恶性肿瘤的血管生成密集且生长迅速。因此,血管生成在肿瘤的发展转移过程中起到重要作用,抑制这一过程将能明显阻止肿瘤组织的发展和扩散转移。
·
新生血管的生长和成熟是一个相当复杂和协调的过程,血管的形成与发展取决于血管生成促进因子和抑制因子的动态平衡,需要细胞与细胞、细胞与基质的相互作用,需要一系列的受体被激活,并由多种促血管生长因子和血管生成抑制因子调节。
·
随着对实体肿瘤的血管生成和功能认识的深人,大量的促血管生长因子及血管生长抑制因子的发现使人们认识到肿瘤内血管的生长也具有可调节性,由肿瘤细胞自身分泌的
VEGF
和血管生成素
(Ang)
可诱导肿瘤血管生成。
目前已发现 VEGF、bFGF、IGF-1、TNF-α、TNF-β、和血小板衍生生长因子(PDGF)等20多种促血管生长因子
。
o VEGF 及 其 受体(VEGFR)是目前发现的最重要的促肿瘤血管生长因子,它能促进肿瘤血管内皮细胞的增殖、迁移和存活,增加肿瘤新生血管的通透性,在肿瘤血管生成过程中发挥关键作用,其中VEGF165的促血管生成作用最强,它主要与 VEGFR-2结合发挥重要功能。多种调节因子能通过直接或间接途径影响VEGF及其受体信号的转导作用,Neuroplin-1可作为辅助受体与VEGF165结合,从而加强VEGF165与VEGFR-2的结合能力,促进肿瘤血管生成。缺氧诱导肿瘤细胞产生大量的缺氧诱导因子-1(HIF-1),上调 VEGF及其受体的表达,从而促进肿瘤新生血管的形成。bFGF、IGF-1、TNF-α、TNF-β和PDGF等在体外可增加特定肿瘤表达VEGF,提示这些因子对血管生成的调节作用部分是通过上调VEGF表达实现的。bFGF还能影响内皮细胞的迁移,促进血管管腔形成,刺激内皮细胞分泌胶原酶,降解基膜,以利于新生血管生长。
o 第二类促血管生成因子家族,即 Ang 及其受体。到目前为止,人们发现4种该家族成员,即Ang1-4,Ang-1是由肿瘤细胞分泌的促血管生长因子。Ang 受体Tie是内皮细胞特异的酪氨酸激酶受体,主要分布于内皮细胞和造血细胞表面。Ang1-4特异性地作用于内皮细胞,具有很强的促血管生成活。Tie-1和Tie-2受体及Tie-2的配体(Angl,Ang2)在胚胎血管形成和血管生成中起重要作用。激活Tie-2/Ang-1信号通路能诱导毛细血管出芽形成分支,募集血管周细胞和平滑肌细胞,维持血管稳定性,同时活化内皮细胞磷脂酞肌醇激酶(PI3),使凋亡抑制剂Survivin生成增多,对抗内皮细胞凋亡。Ang和VEGF家族在血管生成过程中相互补充和协调。VEGF在血管生成早期阶段发挥关键作用,而Ang家族是在后期的血管成熟和进一步稳定中发挥重要作用。
·
血管生成与新生参与了许多疾病的发生、演变和进展,包括最常见和致命性心血管疾病、癌症、糖尿病、炎症及眼科疾病等。
·
在生理条件下,血管生成分为两种过程:一种是利用内皮祖细胞,其来源于骨髓,并启动内皮生长和血管生成;另一种是根据现有的脉管系统生成新的血管,高度依赖于内皮细胞的活化和蛋白酶的分泌。生理条件下的血管生成包括胚胎发育、损伤修复等。
·
在病理条件下,血管生成的步骤基本与正常生理条件下的一致,然而形成的结构通常在功能上是异常的。
病理状态下的血管生成包括如下情况:
o 过量血管生成:如肿瘤生长与转移、类风湿关节炎、糖尿病性视网膜病变、炎症性疾病、动脉粥样硬化。
o 血管生成不足:如慢性损伤、冠状动脉疾病、中风、不愈合骨折。
o血管萌发:血管生成的第一步是血管内皮细胞的分化和转化为成熟血管的前体细胞,这些细胞称为“血管萌发点”。
o血管延伸:血管萌发点开始向周围细胞或组织延伸。该过程可能涉及被称为“引导策略”的信号分子,以帮助方向性移动。
o 血管融合:在不同位置生长的血管可能会相互靠近起来。这些血管随后会通过一系列复杂步骤融合,形成全新的循环系统。
o血管变化:一旦形成,成熟的血管可能会改变其形态和结构以适应环境。例如,某些部分可能需要增加灵活度,以便在控制血液流量时避免大气压力,同时其他部分可能需要增加强度和稳定性以支持负重。
·
目前可使用多种方法来研究血管生成过程,包括
杂交瘤模型、血管形成实验、鸡胚膜血管生成实验、管腔形成实验、小鼠Matrigel注射、兔角膜血管生成实验
等。
实验方法 |
研究应用 |
相关机制通路蛋白 |
优点 |
缺点 |
杂交瘤模型 |
肿瘤血管生成与抑制剂研发,肿瘤转移机制的探索 |
VEGF, VEGFR, Angiopoietin, Tie等 |
可快速建立血管生成模型,可评估药物对肿瘤血管生成的影响 |
不完全模拟真实的血管生成过程,模拟复杂性较低 |
血管形成实验 |
心血管疾病研究,糖尿病相关视网膜血管生成的研究 |
VEGF, FGF, Notch, TGF-β等 |
可模拟血管生成过程 |
缺乏机械刺激、生物信号和细胞间相互作用等重要因素 |
鸡胚膜血管生成实验 |
血管生成与血管新生抑制剂筛选,癌症血管生成机制研究 |
VEGF, FGF, Angiopoietin, Tie等 |
提供三维环境和细胞-细胞相互作用 |
对实验条件要求较高,如鸡胚选择和操作技能 |
管腔形成实验 |
血管生成和管腔形成机制的研究 |
VEGF, VEGFR, Notch, Ephrin等 |
模拟真实的管腔形成过程 |
实验难度较高,对细胞和基质的处理需求技术储备 |
小鼠Matrigel注射 |
肿瘤血管生成与抑制剂研发,血管生成调控因子的筛选 |
VEGF, Angiopoietin, TGF-β, FGF等 |
可评估血管生成能力和药物对血管生成的影响 |
仅模拟早期血管生成阶段,无法考虑后续进程 |
兔角膜血管生成实验 |
血管生成和角膜疾病相关机制的研究 |
VEGF, FGF, Notch, TGF-β等 |
提供动态观察血管生成过程的机会 |
实验操作复杂,对设备和动物管理要求高 |
·
血管生成实验
(Angiogenesis Tube Formation)
是体外研究血管生成的经典方法,该方法可快速确定参与血管生成的基因或通路,体外的血管生成实验能很好的模拟肿瘤的血管发生过程,并且适合研究药物对这一过程的影响实验。
·
主要原理是内皮细胞保留了分裂和快速迁移的能力,可响应血管生成信号。基于内皮细胞在基底膜提取物(BME)上培养时形成三维毛细血管样管状结构的能力,是一种简单、定量、可靠且功能强大的模型,常用于研究血管生成的抑制剂和激活剂。
·
多种类型的内皮细胞均可用于本实验,包括原代细胞和永生化细胞系。
常用的有人脐静脉内皮细胞(HUVEC),之所以不采用静脉血管内皮细胞与动脉血管内皮细胞是因为HUVEC具有干细胞的潜能,理论上可以传代50-60次
。
此外小鼠3B-11细胞、小鼠SVEC4-10细胞或原代内皮细胞也可用于血管形成实验。
o1984年,HUVEC细胞株由Hiroyoshi Hoshi、Wallace L.Mckeehan从一段长约10-20cm的人正常脐带静脉中获取、建立。
oSetsukoShioda等研究发现,HUVEC细胞株18-30代的倍增时间为23.5个小时,24-27代的倍增时间为67个小时,27-30代的倍增时间为84个小时,32-34代的倍增时间为100个小时。培养至40代后,细胞形态出现多样化,有些细胞变大或变小,有些细胞出现多核;细胞密度下降、倍增时间延长。最后细胞在第54代停止生长,ATCC的预期寿命也显示在50-60代。
o2018年,Setsuko Shioda等发现HUVEC细胞株(Passage 31)在贴壁汇合时细胞与细胞之间存在间隙,这与典型的内皮细胞特征有所不同。
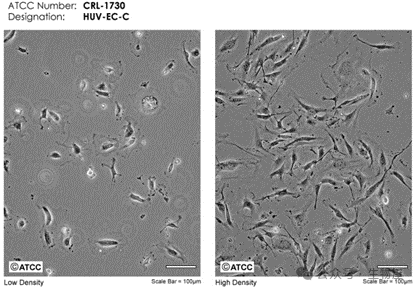
o来源方便:HUVEC来源于新生儿的脐带组织,容易获取,没有伦理争议,且便于提取足量细胞。从人脐静脉细小的血管组织中分离出内皮细胞,原代提取及培养工作量大。
o具有细胞成管的能力:此为内皮细胞最基本的特征。
o原代HUVEC最接近人自体内皮细胞,体现新生血管内皮的特点。
·
仪器:生物安全柜、微量移液器、培养箱、冰箱、离心机、细胞计数仪、倒置显微镜
·
培养基:
Endothelial cell growth medium (ECM), DMEM
·
基质胶:
BD MatrigelTM,
Cat#
354230
·
耗材:血管生成载玻片
, ibidi, Cat#81506 / 96-well plate
·
其它试剂:胰酶,
PBS
,细格纸,免疫荧光染料
Calcein AM
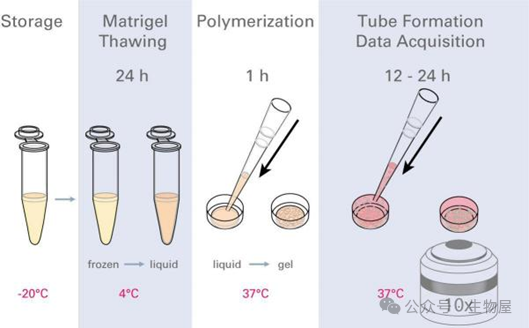
图1. 实验流程图
1)
实验前一天将
Matrigel
置于冰盒中,放入
4℃
冰箱,使胶能过夜缓慢融化。
(
注意:同样要准备一些
4℃
预冷的枪头用于吸取
Matrigel)
2)
开始实验前,
Matrigel
始终放置在冰盒中。
3)
打开灭菌包装,取出
ibidi
血管生成载玻片。
4)
每孔中加入
10 μl Matrigel
。
(
注意加入
Matrigel
时枪头要垂直于内孔的正上方,防止有
Matrigel
流经上孔而留下残留胶
)

由于
Matrigel
流动性不强,如果移液枪不准确,有可能打入
10 μl
的胶,却不能填满血管生成载玻片的下孔
——
这样,必然会影响到实验的成像结果。
如何判断是否加入了合适体积的
Matrigel
?
我们只需用一张格子纸就能知道自己的移液枪调整到多少能正好把下孔填满。
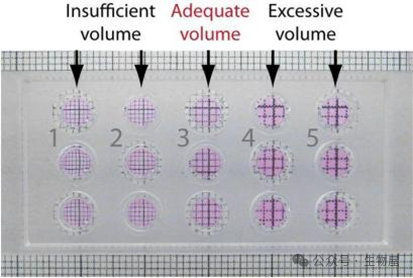
如上图所示,垂直透过每个孔看下面的格子纸,如果格子被缩小了,那么就说明胶没加满,格子被放大了,那么胶就加多了,格子没发生什么变形,这才是刚刚加满下孔的状态。
2)
准备一个
10 cm
的培养皿,放入浸过水的纸巾,制成一个湿盒。
3)
将
ibidi
血管生成载玻片放入培养皿中,盖上培养皿盖。
4)
将整个培养皿放入培养箱中,静置
30
分钟左右,等待胶凝结。
由于加入细胞的量直接影响实验结果,所以在正式实验开始之前,要对不同类型的细胞和使用量进行预实验。获得最佳比例的细胞密度。今天的实验使用
HUVEC
细胞,每孔种
10,000
个细胞即可。
1)
准备密度为
2*10^5 cells/ml
的细胞悬液,充分混匀。
2)
将胶已经凝固的
ibidi
血管生成载玻片从湿盒中取出。
3)
每孔加入
50 μl
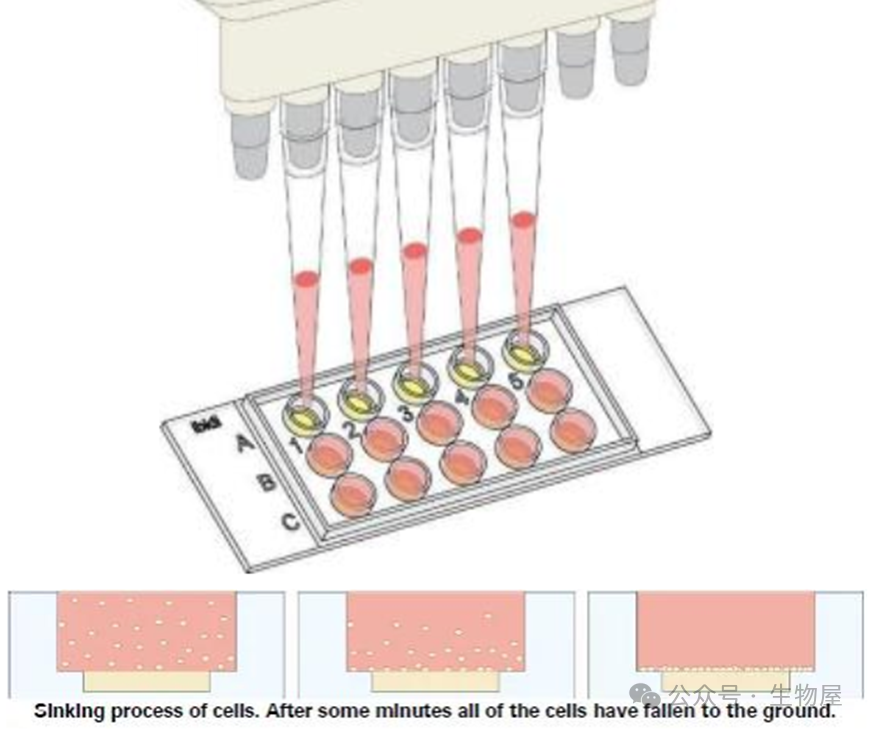
的细胞悬液,注意保持枪头垂直在上孔的上方,不要接触下孔的凝胶。可以使用排枪。
4)
同样用格子纸查看是不是加了足够量的液体,如果没有,加入无细胞的培养基,使上孔液体正好加满。
5)
盖上盖子,静置,一段时间后,所有细胞都会沉下去落在
Matrigel
的表面。
可以按照细胞的生长速度定时采集图像,并且对其成管长度、覆盖面积、成环数、结点数进行测量和记录,并且对其进行统计分析。
1)
小心的移除上孔内培养基,注意不要碰到胶或者细胞网络。
2)
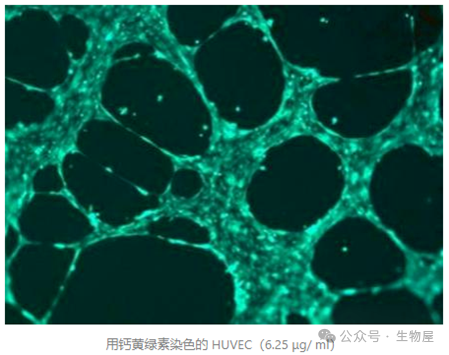
加入
50 μl
用无血清培养基稀释的钙黄绿素
Calcein AM (12.5 µl Calcein AM stock 1 µg/µl)
,使其终浓度为
6.25 µg/ml(1:160)
。
4)
使用
PBS
清洗三次,注意,
PBS
要缓缓加入上孔,以免冲击掉细胞。
5)
使用
Ex/Em=485nm / 529nm
进行免疫荧光成像。
1.
本
Protocol
选用
HUVEC
细胞。使用标准的传代细胞程序,使用
3-5
代状态较好的细胞,并使其在
24
小时内
~80%
汇合度。然后对
HUVEC
细胞进行饥饿处理:将完全培养液换成含
0.2% FBS
的
DMEM
培养液,培养
24
小时。
2.
解冻基质胶,从
−20℃
或
−80℃
冰箱中取出基质胶,放入
4℃
的冰箱中直至解冻,使用预冷的移液管或枪头混合基质胶至均匀状态。
3.
稀释基质胶,用培养液将基质胶稀释到
8-12mg/mL
,可根据实际情况进行调整。
4.
将完全解冻的基质胶放至在冰上,翻转几次以混合内容物,后每孔加入
50μL-80μL
。
5.
将
96
孔板转移到细胞培养箱中,在
37℃
下孵育
30 min
,使基底膜形成凝胶。
6.
配制系列浓度的样本工作液,设置测试组,阳性对照组,空白对照组。
7.
对
T75
瓶中达到
80%
融合的
HUVEC
细胞进行消化,离心,计数。
8.
将细胞重悬在含
10%
的
FBS
培养基中,使浓度为每毫升含
30w-50w
个细胞的单细胞悬液。
9. 96
孔板中每孔加入
100μL
细胞悬液
(
含
3-5w
个细胞
)
。
10.
将
96
孔板置于
37℃
,
5% CO2
,
90%
湿度条件的培养箱培养,并在
2
、
4
、
6
、
8h
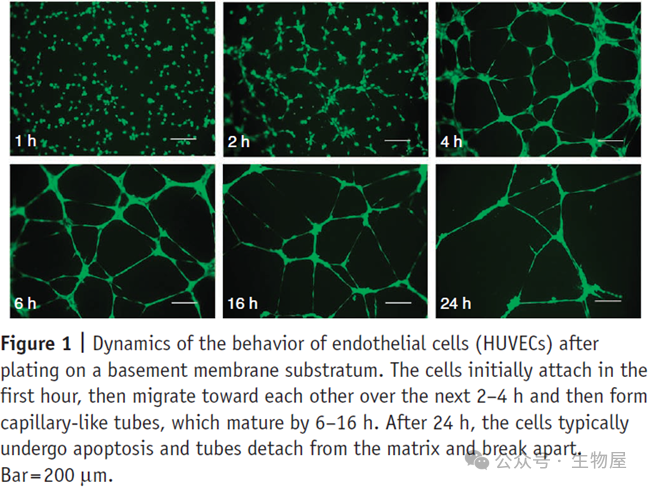
时间点拍照观察,
3-12
小时可见血管网络形成,成管时间与细胞状态密切相关。
(
注意:
Tubes
将在
2-4
小时内开始形成,这取决于培养基中血管生成因子的浓度,小管形成的峰值可能发生在
3-12
小时之间,并且需要优化检测的时间。如果使用原代内皮细胞而非永生化细胞,开始成管的时间会延迟几个小时。一般而言成管会在
18
小时内开始恶化,内皮细胞将发生凋亡
)
11.
将拍好的照片用
Image J
插件
Angiogenesis Analyzer
进行定量分析。
1.
细胞传代次数很重要,当细胞在第
2
代和第
6
代之间时,血管形成效果最好;使用第
2
代之前或第
10
代之后内皮细胞会影响。实验用细胞如果是从人脐静脉获得,内皮细胞不应超过第
12
代,并且细胞从液氮中取出后至少传代两次,然后用于实验。
2.
基质胶非常容易形成凝胶状态,在解冻过程中全程放在
4℃
,在
96
孔板移液过程中全程在冰上操作。因此移液枪头也需要提前放至
4℃
预冷,也可将需要预冷的材料放至
-20℃
急冻。
3.
在向
96
孔板中铺胶时,小心且垂直地将液体移入孔中,避免基质胶液体中出现气泡。如果出现气泡,将
96
孔板在
4℃
下以
300g
离心
10 min
,确保离心机预冷至
4℃
。
4.
在
37℃
凝胶期间不要摇晃平板,因为这将导致凝胶表面不均匀。
96
孔板铺胶时,经常会出现凝胶表面波不平的情况,这是由于液体的张力和
96
孔板空面积较小所致,条件允许的情况下可用
48
或
24
孔板代替,更大的表面积可以使胶面更均匀平整。
5.
凝胶形成后先观察凝胶的形成状态,常会出现类似沙丘的隆起和沟壑,这时需要静置更长的时间,确保凝胶表面是平整均匀的状态后再进行实验。
6.
在种细胞时,细胞活率要大于
95%
才可用于实验并得到一个准确的结果。
7.
当将细胞添加到孔中时,要确保细胞混合均匀,因为细胞密度对管的形成有影响。在加入细胞时,不要接触凝胶的表面,并缓慢地加入细胞悬液,以免损伤凝胶材料。
8.
在试管实验的第一个小时,不要摇动平板或将其从细胞培养箱中取出。在显微镜下观察平板时,不要在细胞培养箱外保存超过一两分钟。
9.
细胞状态非常影响成环结果,因此细胞状态,接种细胞的密度均需要提前做预实验进行摸索。
10.
样本的制备可以和细胞悬液一起制备好后再加入到孔板中进行孵育,这样省去了样本制备的步骤,也可让样本和细胞更充分的接触,实验结果更具有说服力。
11. HUVEC
细胞容易沉底,易使孔间细胞数量不一致,细胞数量不一致会影响成管结果,数量多的孔容易成管。每孔加样前需用移液器吹打混匀。
12.
实验前一天无血清饥饿细胞,第二天成管效果会更好。
13.
加基质胶一定垂直悬空滴入孔底部,避免沾到孔板壁上,移液枪到达第一档,减少气泡产生,使用摇晃的方法让胶均匀分布。
14.
滴加细胞悬液时垂直加入,避免戳到下边的凝胶。
15.
铺胶或分装前需要准备一些
4℃
预冷的枪头
,EP
管,
96
孔板。
16.
基底膜提取物
(basement membrane extract, BME)
浓度因批次而变化很大,如果浓度低于
10mg/ml
,
BME
就不能很好工作,因此应该在购买之前联系代理商。
17.
用于信号通路研究时,低生长因子的
BME(Reduced growth factor BME)
比起传统的
BME
更可取,因为排除了生长因子的干扰。
18.
过薄的
BME
胶不能够支持内皮细胞形成血管,一般来说,
96
孔板中使用
50-80 μL/
孔的
BME
较为合适。
19.
以
HUVECs
为例,比较孵育
16 h
后的状态:
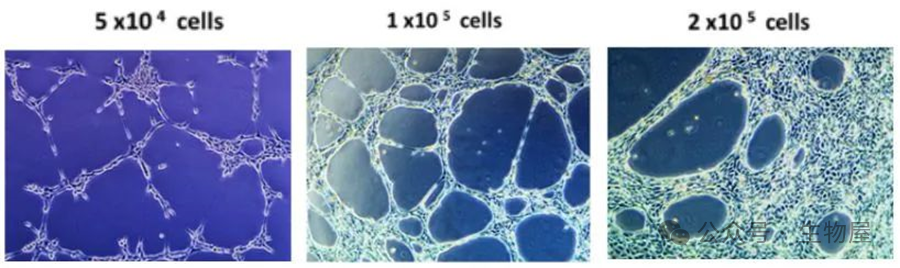
HUVECs
的细胞接种密度影响血管样网络的形成,细胞接种密度在
4,800-6,400
细胞
/cm²
为最优。
20.
根据分析的细胞类型而定,原代内皮细胞在
6-20 h
内形成血管样网络,小管形成的峰值可能发生在
3-12 h
之间,并且需要优化检测的时间,永生化细胞在
2-3 h
内形成血管。一般而言成管会在
18h
内开始恶化,内皮细胞将发生凋亡。
21. ibidi
血管生成载玻片和
96
孔板的区别:
ibidi
血管生成载玻片能节省更多基质胶,降低实验成本;分上下孔的
ibidi
血管生成载玻片能去除凹液面,使成像效果更好。
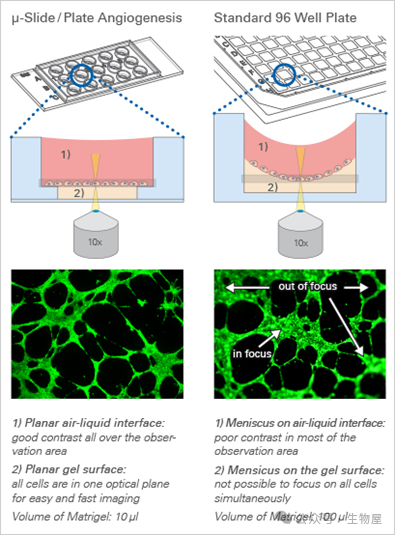
左侧ibidi 血管生成载玻片无凹液面,整个视野成像清晰;
右侧 96 孔板有凹液面,中间清晰周围模糊。
用不加双抗、不加胎牛血清的高糖的
DMEM
培养基稀释。
枪头要垂直于内孔的正上方加入基质胶,防止有基质胶流经孔壁而留下残留胶。若是孔的底部没有铺满胶,可以晃动一下
96
孔板,使底部铺胶均匀,若还是没有均匀,可用枪头稍微搅动一下。
4. HUVEC
必须用专用培养基吗?能不能用普通培养基?
用普通培养基的话,还要添加生长因子,常见的有
ECGF/ECGF
,
ECGF
,但价格贵,不如专用培养基来的划算,故推荐使用专用培养基。
5.
进行血管形成实验,应该选用多大浓度的基质胶呢?
最低浓度应不低于
10mg/mL
,
基质胶的稀释比例是
6 mg/mL
以上。成管效果最好的是
6-8 mg/mL
。
可能原因包括:
(1)
是培养液的
pH
值与细胞正常所需
pH
值差别太大,导致细胞代谢异常,出现空泡化;
(2)
是在细胞培养过程中,由于血清浓度不够、药物作用、外界刺激等情况下导致细胞代谢出现问题,内质网应激状况下会出现细胞空泡化的情况。
1.
测定完培的
pH
,看其酸碱性是否适宜。多数细胞适宜的
pH
范围为
7.2-7.4
。
2.
若培基或血清是开封存放很久的,可换用新鲜的完配给细胞换液;若都是新开封的,可换用新批次的基培或血配制培养液,给细胞换液观察。
原因分析:可能由于培养板亲水性差或者血清中的促贴壁因子不足。
(1)
培养瓶使用前一天使用明胶包被,包被方法:以
T25
瓶为例,取用
5ml
明胶放入
T25
瓶,放置
37℃
下
30
分钟以上,后将多余明胶吸出。
(3)
培养基使用
ECM
内皮专用培养基进行配置。
将孔板下面放置一张格子纸
(
如图
)
,垂直透过每个孔观察下面的格子纸:
(1)
如果观察到的格子比实际尺寸小,判断基质胶加入体积不足;
(2)
如果观察到的格子比实际尺寸大,判断基质胶加入体积过多;
(3)
如果观察到的格子与实际尺寸一致,判断基质胶加入体积合适。

10.
为什么我的成管实验中细胞不能形成连续的网格?
建议使用
3-5
代状态较好且融合度
70%-80%
的
HUVEC
细胞进行成管试验,此时细胞成管能力比较强。
在使用胰酶消化细胞时,在显微镜下边观察边消化,当细胞变圆时及时终止消化过程。消化过度会影响成管。
尽可能保证细胞数量为约
3
万个
/
孔,细胞数量过少会使细胞无法形成连续的网络。
选择低生长因子基质胶进行成管实验时,可考虑在培养基中添加生长因子刺激细胞成管。
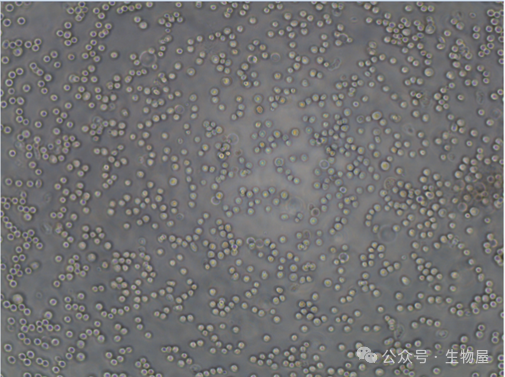
由于计数方式的差异可能导致细胞数量的差异,可进行预实验测试合适的细胞数铺板,细胞静置后镜下观察如下图数量比较适宜。
12.
成管实验到底需要几个小时?
6
个小时?
20
个小时?小管形成后有塌缩了?
成管时间与细胞状态密切相关。细胞状态好时,
2-3
小时开始成管,细胞状态较差时,可能
18-24h
成管。建议第一次实验时,每
4
个小时观察一次。
成管时间取决于培养基中血管生成因子的浓度,肿瘤条件培养基中血管生成因子较丰富,容易成管,而基础培养基成管时间较久。
如果使用原代内皮细胞而非永生化细胞,开始成管的时间会延迟几个小时。
小管形成后有塌缩
:
可能是培养时间过久,内皮细胞发生凋亡导致。
13.
管形成实验中使用含酚红的凝胶还是不含酚红的凝胶?
对于使用
µ-Slide
血管生成的管形成测定中的相差显微镜,酚红不会干扰图片,并且由于其颜色,处理更容易。然而,当使用荧光显微镜时,酚红可能会干扰探头的波长。在这种情况下,最好使用无酚红凝胶。
1. Hepatocyte growth factor induces a proangiogenic phenotype and mobilizes endothelial progenitor cells by activating Nox2. Antioxid Redox Signal, 2011, 15(4):915-923.
2. miR-153 inhibits the migration and the tube formation of endothelial cells by blocking the paracrine of angiopoietin 1 in breast cancer cells. Angiogenesis, 2018:1-12.
3. Tumor necrosis factor-α promotes the lymphangiogenesis of gallbladder carcinoma through nuclear factor-κB-mediated upregulation of vascular endothelial growth factor-C. Cancer Sci. 2014 Oct;105(10):1261-71.
4. The differentiation of hMSCs counteracts their migration capability and proangiogenic effects in vitro. Oncology Reports, 2016, 35(1):219-226.
5.Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285(21):1182-1186. doi:10.1056/NEJM197111182852108
6. Angiogenic signaling pathways and anti-angiogenic therapy for cancer. Signal Transduct Target Ther. 2023;8(1):198. Published 2023 May 11. doi:10.1038/s41392-023-01460-1
7. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat Protoc. 2010;5(4):628-635. doi:10.1038/nprot.2010.6
8. IKK beta suppression of TSC1 links inflammation and tumor angiogenesis via the mTOR pathway. Cell. 2007;130(3):440-455. doi:10.1016/j.cell.2007.05.058
9. Advanced tube formation assay using human endothelial colony forming cells for in vitro evaluation of angiogenesis. Korean J Physiol Pharmacol. 2018;22(6):705-712. doi:10.4196/kjpp.2018.22.6.705

